
A PET alkalmazása Magyarországon
PET a koponyaűri diagnosztikában
Borbély Katalin - Nyáry István
A PET-vizsgálat olyan funkcionális, nem invazív vizsgáló eljárás, amellyel számos élettani folyamat in vivo monitorozható. A PET az élő szövetekbe juttatott izotópok sugárkibocsátását érzékeli és képezi le. Az adott szerv funkciójától függően megválasztható az a molekula, amelynek affinitása van a vizsgálni kívánt funkcióhoz, szervhez. Megjelöljük izotóppal (létrejön a radiofarmakon), a betegbe juttatjuk és a radiofarmakon eloszlását a célszerűbben PET technikával mérjük. A PET módszert a műszerek folyamatos tökéletesítése és a radiofarmakonok állandó fejlesztésének széles körű lehetőségei az agy funkcionális nem invazív vizsgálatának arany etalonjává tették.
A debreceni PET centrumban neurológiai indikációval végzett PET vizsgálatok megoszlását az 1. táblázatban foglaltuk össze. Intézetünkben évente közel 700 koponyaműtét történik intrakraniális tumor indikációjával, amelynek több mint a fele glioma. E területen a PET szerepe nemcsak fontos, de gyakran nélkülözhetetlen. Jelentős számban szerepelnek még intézetünk beteganyagában olyan betegek, ahol a differenciális diagnosztikában, a műtéti indikáció felállításában és a műtéti tervezés során a PET vizsgálatok ugyancsak fontosak, olykor nélkülözhetetlenek. Betegeink nagy részében viszont ezek a vizsgálatok nemcsak fontosak, de sürgősek is, tekintettel a koponyaűri folyamatok gyors progressziójára. Az ilyen állapotú betegek nehezen, vagy egyáltalán nem szállíthatók. Ezen felül vannak olyan betegek, akiknek a súlyos általános állapota nehezíti, illetve teszi lehetetlenné a betegszállítást. Előbbi okok miatt, a PET indikációjú betegeink jelentős része sajnos nem kerülhet PET vizsgálatra.

1. táblázat • Neurológiai indikációjú PET vizsgálatok megoszlása
Az elsődleges koponyaűri daganatok a halálokok 1,2%-át jelentik, amelyeknek több mint 50%-át a gliomák képezik. A terápiás stratégia kialakításában alapvető fontosságú a tumorok malignitásának (rosszindulatúságának) meghatározása (1-4). A CT és MR technikák kitűnően mutatják a szövetek morfológiáját (szerkezetét), kontrasztanyag felhasználásával segítik az differenciáldiagnózist, de nem mindig eredményesek az agyi megbetegedések elkülönítésében, valamint a daganatok biológiai magatartásának meghatározásában. A tumorok malignitási fokának a kontrasztanyag-halmozás nem érzékeny jelzője, a jelenléte vér-agy gát károsodásra utal, amely egyéb kórfolyamatokban is fennáll. A szövetminta hisztológiai vizsgálatának eredménye a mintavétel helyének szoros függvénye, ami nem biztos, hogy a tumor malignus, illetve legmalignusabb részéből származik. Problémát jelenthet a daganatok pontos határának megállapítása, műtéti beavatkozást vagy sugárterápiát követően pedig a recidív (kiújult) tumor elkülönítése a sugár- és/vagy kemonekrózistól.
Napjainkban két technológia segítségével jutunk biológiai információhoz, az MRS (MR-Spektroszkópia) és PET eljárásokkal. Az MRS a szöveti anyagcseretermékek koncentrációjáról ad felvilágosítást, PET vizsgálatokkal szöveti metabolizmust (anyagcserét) mérünk. Az MRS klinikai alkalmazása mind a mai napig korlátozott, hazánkban nem elérhető.
A gliomák glükózfelhasználása egyenes arányban áll a malignitási fokukkal (1. ábra). A glükózfelhasználás csúcsát mérve a tumorok területében, szignifikánsan magasabb értékeket találunk a szövettanilag rosszabb indulatú daganatokban, mint a benignus (jóindulatú) formákban (2-4). FDG-PET módszerrel megbízhatóan detektálható a daganatok malignus átalakulása. A módszer nélkülözhetetlen a kiújult daganat és a sugár-, illetve kemonekrózis elkülönítésében. A nekrotikus, halott szövetben a glükóz-anyagcsereszint csökkent, ellentétben az élő tumorszövet glükózfelhasználási szintjével, igényével (3-5).

1. ábra • Fúziós, transzverzális (felső sor), szagittális (középső sor), koronális (alsó sor) Ti súlyozott MR és FDG-PET képek. Jobb oldali frontocentrális elváltozás: a kiterjedt frontális műtéti jelszegény (MRI) és hipometabolikus (FDG-PET) terület dorzális részén kb. 6 cm átmérőjű, lassú proliferációra utaló (alacsony glükózanyagcsere) kiújult glioma.
A daganatsejt aminosav transzportjának követése PET módszerrel ugyancsak alkalmas és hasznos a tumorok diagnosztikájában (6-7). A 11C-Metionin (Met) trészer (radiofarmakon) jól használható a daganatok határainak pontos meg jelölésére (2. ábra), különösen a benignus, de "lokalizációnál fogva" rosszindulatú tumorok határainak pontos megjelenítésére. A 11C-Met-PET vizsgálatok fontosak a tumorok és nem tumorok elkülönítésében.
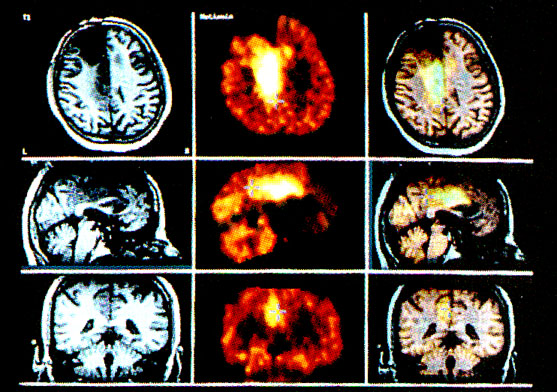
2. ábra • Fúziós, transzverzális (felső sor), szagittális (középső sor), koronális (alsó sor) T1 súlyozott MR és Met-PET képek. Jobb oldali frontocentrális elváltozás: a kiterjedt frontális műtéti terület dorzális részén kb. 6 cm átmérőjű körülírt területen, intenzív 11C-Met felvétel (kiújult glioma).
A PET-anyagcsere térkép értékeléséhez mind a klinikai, mind a morfológiai adatok (MR, CT) ismerete szükséges. Kisebb kiterjedésű elváltozások, illetve azok határainak egyértelműbb és megbízhatóbb megjelenítéséhez a morfológiai és funkcionális adatok egymásbavetítése (fúziója) különösen hasznos (1., 2. ábra). A daganatok és egyéb koponyaűri folyamatok elkülönítésében a tisztázandó kérdés függvényében különböző PET anyagcsere, véráramlás, receptoraktivitás stb. vizsgálato(ka)t végzünk.
A meningeomák a koponyaűri daganatoknak kb. 14%-át teszik ki. Általánosságban benignus daganatként elfogadott elváltozások, amelyek sebészi beavatkozással gyógyíthatók (8). Irodalmi adatok szerint a szövettanilag benignus meningeomák 29%-a recidívál. Az áttétet okozó meningeomák több mint 50%-a eredetileg benignus formából eredt. A kiújulás lehetőségét fokozza a funkcionálisan fontos kérgi területek, koponyacsont, duralis szinuszok érintettsége, amelyek a teljes eltávolítást megnehezítik, olykor lehetétlenné teszik. Jelentősen alacsonyabb glukózfelvételt mutatnak azok a meningeomák, amelyek növekedési és kiújulási tendenciája elmarad a malignus típusú tumoroktól. Azok a meningeomák, amelyek magas glükózfelhasználási szintet mutatnak, műtétet követően relatíve gyorsabban kiújulnak és növekednek (3. ábra) (9).

3. ábra • FDG-PET transzverzális képek. A bal oldali frontális paraszagittális meningeoma teljes eltávolítását a szinusz érintettsége nem tette lehetővé. A nem eltávolítható tumorszövet (baloldali kép) glükózfelvétele magas (gyors növekedési és kiújulási tendenciára utal). Műtétet követően három hónappal a meningeoma 3x4 cm átmérőjű, területében intenzív glükózfelhasználás.
A koponya és a nyak schwannomáinak diagnosztikájában és követésében az FDG-PET módszer ugyancsak hasznos eszköznek bizonyult, a tumorok biológiai magatartásával szoros párhuzamot mutat. A módszer segítségével a tumorok agresszivitása és kiújulási készsége felmérhetá (10). A mikro- és makroadenomák glukózfelhasználási szintje jól korrelál a daganatok növekedési képességével, de nem utal a tumorok hormonszekréciójára (11).
A metasztázisok (áttéti folyamatok) gammakés-sebészetében a PET módszer fontos szerepet játszik, meghaladja a CT és MR technikák érzékenységét, különösen a kiújult áttét és a besugárzás következményeként kialakult nekrózis elkülönítésében (12).
Terápiarezisztens fokális epilepsziában szenvedő betegek számára az egyetlen ígéretes terápiás megoldást nyújtó epilepsziasebészet eredményességének alapvető feltétele az epilepsziát okozó kóros agyi terület pontos lokalizálása (13,14). A skalp elektródákkal történő meghatározás kb. 50%-ban vezet pontos diagnózishoz. Az MRI közel 20%-ban nem mutat eltérést. A kimutatott morfológiai elváltozások pedig nem mindig korrelálnak a rohamok kiváltásáért felelős agyi terület klinikai és patológiai azonosításával.
A kóros agyi tevékenységnek a funkcionális képalkotás logikus megközelítése. A PET metabolikus térkép szenzitivitása magas és receptor (18F-Flumazenil) PET vizsgálatokkal kombinálva elérheti a 95%-os megbízhatóságot. Az epileptogén területben rohamközti PET vizsgálat során csökkent glükóz-anyagcsereszintet (hipometabolizmust) (4. ábra), illetve csökkent receptoraktivitást látunk, míg a roham alatti vizsgálat során hiperfunkcióval találkozunk (4,13,14).

4. ábra • FDG-PET transzverzális kép. Jobb oldali temporális hipometabolizmus az epileptogén áreában.
A Parkinson-kór a basalis ganglion betegségek leggyakoribb típusa. A Parkinson-kór tisztán preszinaptikus megbetegedés, míg a "parkinsonizmus-plusz" szindrómák pre- és posztszinaptikus elváltozásokkal járnak. A dopaminerg rendszer megjelenítése már a megbetegedés korai stádiumában hasznos, hisz a betegvezetésben a terápiaválasztáshoz fontos.
A Parkinson-sebészetben az implantátumok posztoperatív követésére az 18F-fluoro-Dopa az optimális, választandó trészer. A parkinsonizmus és egyéb basalis ganglion megbetegedések differenciáldiagnosztikájában, a betegek optimális terápiaválasztásában a különböző gyógyszerekkel (farmakonokkal) végzett receptorvizsgálatok, illetve anyagcsere térkép klinikai jelentősége felbecsülhetetlen (5., 6. ábra) (15-16).
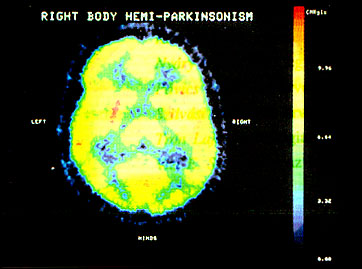
5. ábra • PET transzverzális képek. A posztszinaptikus D2 receptorok megjelenítése 11C-Raclopride trészerrel.

6. ábra • Parkinson-kór korai stádiuma. Hipermetabolizmus a bal oldali nucleus lenticularisban. Jobb oldali hemiparkinson-tünetek. (A jobb oldal minden esetben a kép bal oldalának felel meg (kivétel 6. ábra))
Demenciák. A demencia szindrómák (különböző eredetű emlékezetzavarok) hátterében különböző okok állhatnak (degeneratív, vaszkuláris, traumás, tumoros, fertőzéses, gyulladásos, toxikus és anyagcsere eredet, hydrocephalus és különböző pszichiátriai megbetegedések). A SPECT és PET jellegzetes mintázatot mutat a különböző demenciaformákban, amely szignifikánsan eltér a normál kontrollcsoporttól. Ezek a térképek jól korrelálnak a klinikummal, annak súlyossági fokával, a neuropszichológiai tesztekkel, amely etalonként szerepel a kognitív funkciók megítélésében. A demencia diagnosztizálása a korai stádiumban a legnehezebb. A PET segítséget nyújt: 1) a demenciák differen ciáldiagnosztikájában, 2) a betegség kifejlődésének felismerésében, 3) az agyi elváltozás kiterjedésének és súlyosságának felmérésében a betegkövetés különböző szakaszaiban, 4) a terápiás terv megválasztásában, 5) a klinikai tünetek hátterében az ingerűletátviteli rendszer érintettségének felmérésében, 6) új terápiás beavatkozások hatásának felmérésében, 7) a prognózis megítélésében. Az Alzheimer demencia a temporális (halánték lebeny) és hátsó parietális ífali lebeny) kérgi régiók (kétoldali, de nem mindig szimmetrikus) elváltozásaival kezdődnek. A fronto-temporális demenciák (FTD) jellegzetes funkciócsökkenést a frontális (homlok) lebenyben mutatnak, kétoldali és zömében szimmetrikus, de lehetséges egy vagy kétoldali temporális érintettséggel is. Vaszkuláris demenciák esetében az agyi perfúziós térkép deficitjei a nagyér ellátási területeken belül maradnak. A receptorvizsgálatok segítenek a bazális ganglion degeneráció elkülönítésében. Fontos az időskori demencia és depresszió elkülönítése. Depresszióban csökkent vérátáramlás látható a frontális lebenyben és részben temporálisan. A perfúziós deficitek kevésbé kifejezettek, mint az FTD-ben. A normotenziós hydrocephalus felismerése fontos, mivel gyógyítható demenciatüneteket okoz (17).
Agyér betegségek. A metabolikus eltéréseket a PET korábban és érzékenyebben kimutatja, mint ahogy arra a CT vagy MRI alapján következtetni lehet (18). A regionális véráramlás ismerete önmagában nem elegendő a szövetek életképességének megítélésében. Az oxigén felhasználás mérése 15O inhalációs módszerrel történik és a legmegbízhatóbb mutató. A glükóz extrakciós frakció alacsonyabb, mint az oxigéné. Akut ischaemiás stroke-ban az érintett szövetben többnyire csökken a glükóz anyagcsere, mely elváltozás mértéke és kiterjedése párhuzamban áll a klinikai tünetekkel, azok súlyosságával. A jelzett aminosavak és azok analógjai jól használhatók a stroke-ot követő ischaemiás következmény (protein metabolizmus) kimutatására. A 11C-nimodipine trészer szelektíven kötődik a receptorokhoz az aktivált Ca 2+ láncokon az ischaemiás és penumbra zónában. Azok a betegek, akik maximális regionális vazodilatációs és oxigén extrakciós értékkel rendelkeznek, a legveszélyeztetettebbek, mivel egy további perfúziós nyomáscsökkenést már nem képesek kompenzálni. A fokozott oxigén extrakciós frakcióval kísért hemodinamikai károsodások olykor sikeresen kezelhetők extrakraniális-intrakraniális bypass sebészettel.
TIA (átmeneti neurológiai tünetek) kórtörténetével vagy enyhe stroke-betegekben a vaszkuláris rezervkapacitás gyakran csökkent az érintett agyféltekében, olykor az ellenoldali agyféltekében is, összehasonlítva az azonos korú egészséges egyénekkel (19).
Jól ismert, hogy a stroke betegek terápiás vezetésében, kutatásában a PET szerepe kiemelkedő. A debreceni PET centrumban ezen indikációval végzett vizsgálatok kis számban történnek, melynek oka nagyrészben az intézetek, illetve a helységek közötti távolsággal magyarázható. Akut stádiumban a terápiás ablak rövidsége miatt komoly szervezési problémákkal találkozhatnak az illetékesek, míg krónikus stádiumban a betegek általános állapota nehezíti a szállítást és a távolságok áthidalását.
IRODALOM
1 Borbély K.: Diagnosis, differential diagnosis, and follow-up of intracranial tumors with PET. Gulyás B and Müller-Gartner H.W. Positron Emission Tomography: A Critical assessment of recent trends. Kluwer Academic Publishers, Dordrecht. 1998. Könyvrészlet, 229-236.
2 Di Chiro G., DeLaPaz R.L., Brooks R.A., Sokoloff L., Kornblith P.L., Smith B.H., Patronas N.J., et al.: Glucose utilization of cerebral gliomas measured by [18F] fluorodeoxyglucose and positron emission tomography. Neurology 1982. 32:1323-1329.
3 Borbély K.: PET-FDG vizsgálatok szerepe a gliomás betegek klinikai vezetésében. Referátum. Magyar Rad. 1994. 68:188-192.
4 Borbély K.: A pozitron emissziós tomográfia helye a korszerű betegvezetésben. Orvosi Hetilap 1999. 140(4):171-178.
5 Patronas N.J., Di Chiro G., Brooks R.A., DeLaPaz R.L.; Kornblith P.L., Smith B.H, Rizzoli H.V. et al.: Work in progress: [18F] fluorodeoxyglucose and positron emission tomography in the evaluation of radiation necrosis of the brain. Radiology 1982. 144:885-889.
6 Vaalburg W., Coenen H.H., Crouzel C., Elsinga P.H., Langstrom B., Lemaire C., Meyer G.J.: Amino acids for the measurement of protein synthesis in vivo by PET. Int. J. Rad. Appl. Instrum. B. 1992. 19(2):227-37.
7 Ericson K., Lija A., Bergstrom M. Collins V.P., Eriksson L., Ehrin E.; Von Holst H. et al: Positron emission tomography with 11-C-methyl-L-methionine, 11-C-D-glucose, and 68-Ga-EDTA in supratentorial tumors. J. Comput. Assist. Tomogr. 1985. 9:683-689.
8 Rigó J., Borbély K., Martos J., Horváth M.: Vakságot okozó meningeoma előfordulása terhességben. Magyar Nőorvosok Lapja. 1997. 60:149-151.
9 Di Chiro G., Hatazawa J., Katz D.A., Rizzoli H.V.; DeMichele D.J.: Glucose utilization by intracranial meningeomas as an index of tumor agressivity and probabilíty of recurrence: a PET study, Radiology 1987. 164:521-526.
10 Borbély K., Fulham MJ., Brooks RA., Di Chiro G.: PET-Fluorodeoxyglucose of cranial and spinal neuromas. J. Nucl. Med. 1992. 33:1931-1934.
11 De Souza B., Brunetti A., Fulham M.J., Brooks R.A., DeMichele D.J., Cook P., Nieman L.: Pituitary Microadenomas: a PET study. Radiology 1990. 177:39-44.
12 Mogard, J., Kihlström, L., Ericson, K., Karlsson, B., Wan-Yuo, G., Stone-Elander, S. Recurrent tumor vs radiation effects after gamma knife radiosurgery of intracerebral metastases: diagnosis with PET-FDGimes Júlia Comput. Assist. Tomogr. 1994. 2:177-181.
13 Balogh A., Borbély K., Czirják S., Halász P., Juhos V., Kenéz J., Vajda J.: Tapasztalataink a temporalis epilepsziás betegek műtéti kezelésével - többközpontú vizsgálat. Clin. Neurosci/Ideggy Szle. 1997. 50:221-232.
14 Neuwirth M.. Borbély K., Kopcsányi Zs.: A 99mTc-HMPAO SPECT jelentősége a terápiarezisztens epilepsziás gyermekek kivizsgálásában. Clin.Newosci/Ideggy. Szle. 1997. 50;11-12:386-392.
15 Borbély K., Brooks RA., Wong DF.. Burns RS.. Di Chiro G.. Gjedde A.: DOPA medication inereased radioligand binding to dopamine receptors. Acta. Neurol. Scand. 1999. In press.
16 Borbély K., Brooks RA., Chnse T., Jacob P., Miletich R.: Mapping of cerebral glucose metabolic dysfunetion in parkinsonism. Int. J. Neurorad. 1999. in press.
17 Borbély K., Kordas M., Nyary L: CSF SPECT and brain perfusion SPECT studies in hydrocephalus surgery. Eur. J. Nucl. Med. 1997. 24:8:903.
18 Borbély K, Valavanis A., Von Schulthess GK., Ladd M., Berthold T., Berger C., Buck A.: Assessment of Glucose Metabolic Changes Associated with Cerebral Arteriovenous Malformation Before and After Transarterial Embolization using 18-Fluoro-Deoaryglucose Positron Emission Tomography. Int. J. Neuroradiol. 1997. 3:218-223.
19 Borbély K.: Az emissziós komputertomográfia (SPECT, PET szerepe a stroke-betegek ellátásában. Agyérbetegségek. 1998. 3:3-8.