Nemzetközi eredmények és trendek
A PET a normális agy fejlődésének és gyermekkori neuropszichiátriai kórképeknek a vizsgálatában
Juhász Csaba - Diane C. Chugani - Hary T. Chugani
A pozitron emissziós tomográfia (PET) fejlődésével és egyre több pozitron emittáló-tracer alkalmazásával az elmúlt évtizedben számos agyi folyamat (pl. lokális glukóz elhasználás, agyi vérátáramlás, oxigén-felhasználás, proteir-szintézis, neurotranszmitter funkció) vált közvetlenül vizsgálhatóvá. Gyermekkori PET vizsgálatoknál a leggyakrabban használt tracer a 2-deoxi-2[18F]-fluoro-D-glukóz (FDG), ami lehetővé teszi az agy regionális glukóz felhasználásának mérését. Gyermekkori neuro pszichiátriai kórképeknél a glukóz és egyéb PET vizsgálatok diagnosztikus alkalmazása egyre elterjedtebbé válik, mert PET segítségével olyan betekintést nyerhetünk a központi idegrendszeri betegségeknél zajló pato, fiziológiai folyamatokba, ami korábban elképzelhetetlen volt. Gyermekkori vizsgálatoknál azonban mindig szem előtt kell tartani, hogy a fejlődő agy működése, metabolizmusa, az aktív szinapszisok száma, az agy mielinizációja (magyarázat) és a neurotranszmitter receptorok száma és eloszlása jelentősen különbözik a felnőttekétől. A gyermekkori PET képeken látható kóros elváltozások ezért csak akkor nyújtanak segítséget a klinikumban, ha jól ismerjük a normális agy fejlődése során végbemenő funkcionális változásokat és azok megjelenését a PET képeken. Ezért először a normális gyermekkori fejlődés során létrejövő legfontosabb - a PET értékelését befolyásoló - változásokat tekintjük át, majd röviden összefoglaljuk a PET jelentőségét néhány olyan gyermek neurológiai és pszichiátriai kórképben, ahol a PET alkalmazása jelentős fejlődést hozott a közelmúltban vagy a legújabb eredmények új távlatokat nyithatnak a betegség patomechanizmusának megértésében és a klinikai diagnosztikában.
Az emberi agy fejlődésének vizsgálata PET segítségével
Az agy normális fejlődésének PET vizsgálatát a nyolcvanas évek közepétől az tette lehetővé, hogy egyre több glukóz PET készült olyan gyermekeknél (pl. onkológiai indikációval), akik neuropszichiátriailag normálisak voltak. Ezek a vizsgálatok értékes adatokat szolgáltattak az emberi agy funkcionális fejlődéséről.
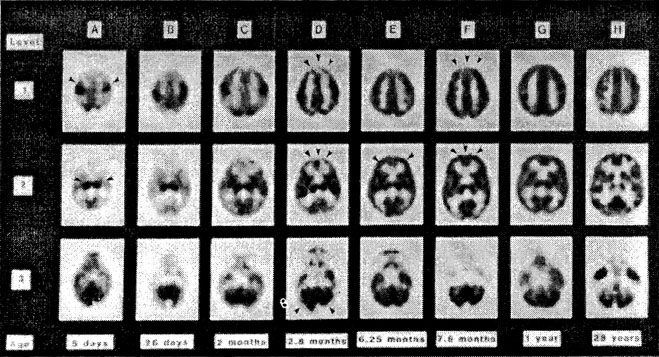
Az újszülött agy glukóz metabolizmusa nagymértékben különbözik a felnőttkorban látott képtől, és a korai fejlődés során jelentős változásokon megy keresztül (Chugani et al., 1986). Újszülött korban készült PET képeken a filogenetikailag ősibb agyterületek mutatnak kiemelkedő aktivitást. Ezek az agyterületek a primitív reflexeket mediálják és egyben meghatározzák az újszülöttek viselkedését. Négy fő agyi struktúra aktív metabolikusan ebben a korban: a szenzomotoros kéreg, a talamusz, az agytörzs és a cerebelláris vermis (1. ábra). Az első életév során az agyi glukóz metabolizmus ontogenezise lényegében filogenetikai sorrendet követ (1. ábra), és az egyes agyi területek metabolikus aktivációja jól korrelál a csecsemő viselkedésbeli fejlődésével. Az agytörzsi reflexek fokozatos szuppressziója és az agyi elektromos tevékenység maturációja a második-harmadik hónapban az agy "encefalizációját" tükrözik, amely a glukóz metabolizmus mintáinak érésében is megnyilvánul. Az első életév végére az egészséges kisgyermek agyi glukóz metabolizmusának mintázata így már nagyrészt hasonlít a normális fiatal felnőttéhez.

1. ábra • Az agy regionális glukóz metabolizmusa a gyermekkori fejlődés során jelentősen változik. Az ábra-sorozaton az agy horizontális metszetein (az elülső agyi területek láthatók felül) megfigyelhető a glukóz metabolizmus változása az életkorral. Az egyes betűkkel jelzett képek a következő életkorban készültek: A: 5 nap; B: 26 nap; C: 2,8 hónap; E: 6,2 hónap; F: 7,6 hónap; G: 1 év; H: 28 év. Újszülötteknél (A) a filogenetikailag ősi agyterületekben (szenzo-motoros cortex, talamusz, kisagyi vermis és agytörzs) a legmagasabb a glukóz fogyasztás. A 2-3. hónap során a glukózfelhasználás fokozatosan emelkedik a perietalis, temporális és látókéregben, a bazalis ganglinokban, valamint a kisagykéregben (B-D). Hathónapos korra a metabolikus ráta a frontális agykéregben is növekedni kezd: először a laterális prefontális régiókban (E), majd a frontális cortex mediális (F). Egyéves korra az agy glukózfelhasználásának regionális eloszlása igen hasonló a felnőttkoriéhoz (G, H), noha az abszolútértékek még jelentős változásokon mennek keresztül (l. 2. ábra).
Az agyi glukózfelhasználás számszerű mértéke (melyet a lokális cerebrális glukóz metabolikus ráta fejez ki) is sajátos változásokat mutat az első életévtizedben. Ezek összefüggenek a központi idegrendszer fejlődésének szakaszaival. Az agyi glukózfelhasználás rapid növekedése csecsemőkorban - legalábbis részben - összefügg a szinapszisok és dendritnyúlványok jelentős túlprodukciójával (Chuganiet al., 1987). Az agyi glukózfelhasználás e látványos emelkedésének összefüggését a szinaptogenezissel állatkísérletes modellek is támogatják: pl. macskánál a vizuális kortex glukózfelhasználásnak meredek emelkedése a 3. hét és a 3. hónap között egybeesik e kérgi terület masszív szinaptogenezisével (Chugani et al., 1991). Bár a közelmúltban embernél a szinaptogenezis és szinaptikus elimináció regionális különbségeit is kimutatták, a szinaptikus kapcsolatok túlprodukciója gyermekkorban hasonló pl. a rhesus majomnál megfigyelthez (Huttenlocher és Dabholkar, 1997). A humán agykéreg glukózfogyasztása a 3-4. életévet követően a felnőttkori szint mintegy kétszeresét éri el, és az ezt követő plató fázis valószínűleg elsősorban a felnőttekéhez képest átmenetileg jelentős többletet mutató idegkapcsolatok fokozott energiaigényét tükrözi. Ez a korszak a fejlődésben meghatározó, mert ekkor az agy jelentős funkcionális plaszticitással bír. Az agy funkcionális fejlődése ebben a korban jelentős mértékben függ a környezetből érkező ingerektől, mely a gyermek kognitív fejlődését meghatározza. A kérgi glukózfogyasztás felnőtt szintre való csökkenése ezt követően az excesszív szinaptikus kapcsolatok szelektív eliminálódásának időszakával esik egybe, és a neuronális kapcsolatok ezután egy alacsonyabb szinten stabilizálódnak (2. ábra).
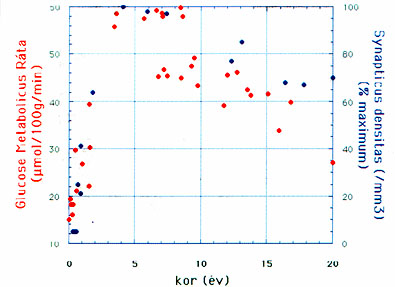
2. ábra • Az agykéreg abszolút glukózfogyasztása és szinaptikus denzitásának változása gyermekkorban. A frontális agykéreg abszolút glukózfelhasználása (pirossal jelölve) az első életévben rapidan emelkedik, majd egy platót elérve fokozatosan csökken a felnőttkori szintre. A prefrontális kérgi területek szinaptikus denzitása (az adott térfogategységre eső szinapszisok száma; kékkel jelölve) hasonló trendet követve változik ugyanezen időszakban
A gyerekkorban magas glukóz metabolikus ráta másik oka az oligodendroglia sejtek nagy energia igénye lehet a mielinizáció szakaszában. Ez a folyamat még a második életévtizedben is folytatódik. Az idegrendszeri pályák elégtelen mielinizációja esetén ugyanakkor az idegvezetés nem megfelelően hatékony, ami szintén magasabb energiaigényt és felhasználást eredményezhet. E folyamatok szerepe az első évtized magas agyi glukózfelhasználásában normál és kóros viszonyok között azonban nem kellően tisztázott.
A fentiek ismerete rendkívül fontos az agy fejlődési zavaraival foglalkozó szakembereknek, és minden olyan esetben is szem előtt kell tartani, amikor az agyszövet egy részének műtéti eltávolítását tervezik, pl. gyógyszerrezisztens gyermekkori epilepsziáknál végzett rezekcióknál (1. lejjebb).
A PET vizsgálatok során alkalmazott újabb tracerek az utóbbi években lehetővé tették nemcsak az agyi glukózfelhasználás, de a fejlődő agy egyes neurotranszmitter-funkcióinak vizsgálatát is. Ezek közül az egyik legújabb és ígéretes lehetőség az agyi szerotonin szintézis PET vizsgálata alfa[11C]metil-L-triptofán (AMT) adását követően (Muzik et al., 1997; Chugani et al., 1998). Főemlősökön végzett vizsgálatok azt mutatták, hogy az agy szerotonin tartalma és a szerotonin receptorok száma az élet első hónapjaiban emelkedik, majd egy csúcsértéket követően fokozatosan csökkenni kezd. Ennek funkcionális jelentőségét az adja, hogy a szerotonin bizonyos életkorban nemcsak ideg-ingerület átvivő anyagként, hanem trofikus és differenciáló faktorként is szerepel: az agyfejlődés során változó szerotonin szint befolyásolja a neuronális differenciálódást (Lauder és Krebs, 1978; Whitaker-Azmitia et al. 1987). Így pl. patkányoknál a szerotonin szerepet játszik a szenzoros kortex posztnatális szinaptogenezisének modulációjában (D'Amato et al., 1987). Ebben a periódusban az agy szerotonin szintjének abnormális növekedése vagy csökkenése a szenzoros kortex szinaptikus kapcsolatainak kóros megváltozását eredményezi (Bennett-Clarke et al., 1994).
A fejlődő humán agy szerotonin szintézisének AMT PET-tel történő vizsgálatai azt mutatták, hogy - hasonlóan az állatkísérletes adatokhoz - normális viszonyok között a szerotonin szintézis kapacitás az élet 3. hónapja és 3. éve között növekszik, és a felnőttkori érték mintegy kétszeresét éri el. Ötéves kor felett ez a szint csökkenni kezd és fokozatosan éri el a felnőttkori értéket (3.A ábra). Ezek a változások azt sugallják, hogy a szerotonin szerepet játszhat a korai agyfejlődésben, és ezen normál változások elmaradása kóros szinaptikus kapcsolatok kialakulásához vezethet. Ez a mechanizmus szerepet játszhat bizonyos kórképek tüneteinek kialakulásában, pl. autizmusban (l. később).
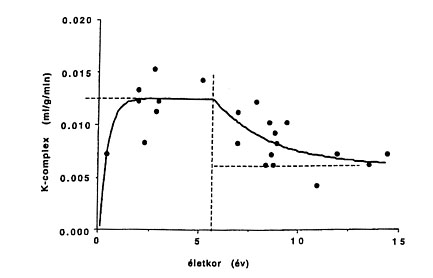
3.A ábra • Az agy szerotonin-szintézis kapacitásának változása gyermekkorban normál viszonyok között. Az érték 2 éves kor körül éri el a maximumot, majd 5 éves kor után fokozatosan csökken a felnőttkori szintre.
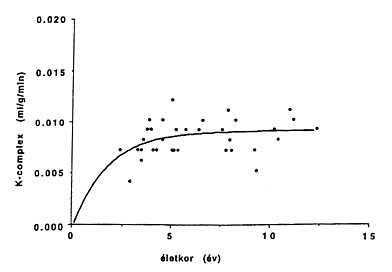
3.B ábra • Autista gyermekeknél (n=30) a szerotonin-szintézis normális változásai nem jönnek létre, az értékek nem haladják meg a felnőttkori szintet. A korai plato elmaradása valószínűleg abnormális szinaptogenezissel jár együtt, ami szerepet játszhat a kórkép tüneteinek kialakulásában.
A PET szerepe gyermekkori lokális epilepsziák preoperatív kivizsgálásában
A gyermekkorban végzett PET vizsgálatok legfontosabb indikációja a gyógyszeres kezelésre rezisztens epilepszia. E betegcsoport különös jelentőségét az adja, hogy epilepszia előfordulása a teljes populációban meglehetősen gyakori (0,5-1,0%), s közülük 15-20% gyógyszeres kezelésre nem reagál megfelelően. A betegség incidenciája gyermekkorban, különösen pedig egyéves kor alatt lényegesen magasabb, és bizonyos formái rendkívül súlyosak nemcsak az alapbetegség nehezen befolyásolható volta, hanem a társuló súlyos kognitív deficit miatt is. Ezeknél a betegeknél sokszor a mielőbbi műtéti beavatkozás az egyetlen lehetőség a gyakori és súlyos rohamok megszüntetésére, ami a betegek kognitív fejlődésének is feltétele. A műtét sikere és a posztoperatív szövődmények elkerülése nagyrészt attól függ, hogy a preoperatív kivizsgálás képes-e felderíteni az epileptogén területeket és nyújt-e kellő információt a tervezett beavatkozás várható funkcionális következményeiről. A műtétek számának emelkedése és a diagnosztikai eszköztár fejlődése egyre égetőbbé tette hatékony noninvazív eljárások alkalmazását a fenti célokra, a korábbi jobbára invazív módszerek helyett.
Gyermekkori fokális epilepsziákban elsősorban a glukóz PET használata terjedt el, mindenekelőtt olyan betegek preoperatív kivizsgálása során, ahol a strukturális képalkotó vizsgálatok (CT vagy MRI) nem mutatnak ki léziót az agyban. Ilyen betegeknél az epileptogén zóna behatárolása korábban szinte kizárólag invazív EEG monitorozás eredményén alapult (szubdurális és/vagy mélyelektródák alkalmazásával). A PET legnagyobb előnye e módszerrel szemben hogy noninvazív és az agy egészéről nyújt funkcionális információt, míg invazív elektródákkal csak az agykéreg töredékéről kapunk közvetlen információt. Ha FDG PET nem detektál körülírt metabolikus eltérést, vagy az abnormitások túl kiterjedtek, további PET tracerekkel végzett vizsgálatok segíthetnek, elsősorban különböző neurotranszmitter receptor funkciók analízise révén. Az utóbbi években különösen két PET tracer, a [11C]flumazenil (FMZ) és az alfa-[11C]metil-L-triptofán (AMT; 1. feljebb) alkalmazása bizonyult hasznosnak e téren. Az FMZ a gamma-amino- vajsav (GABA)/benzodiazepin receptor kompleachez kötődik, amely a központi idegrendszer legfontosabb gátló neurotranszmitterének, a GABA=nak a kötődési helye is. A vizsgálathoz használt flumazenilt eredetileg benzodiazepin túladagolásnál használták az orvosi gyakorlatban. A PET vizsgálatokhoz használt mennyiség, izotóppal jelzett flumazenil észlelhető klinikai hatást nem fejt ki, ráadásul az epilepsziás mintákat az EEG-n szupresszálhatja, így veszélytelenül alkalmazható e betegcsoportban (benzodiazepinekkel való kölcsönhatása miatt ilyen típusú gyógyszert szedő betegeknél a vizsgálat nem végezhető). A módszer kiemelkedő klinikai jelentőségét az adja, hogy az agykéreg és a hippocampus GABA/benzodiazepin receptorainak kóros változásai lényeges szerepet játszanak az epilepsziás működészavar kialakulásában és fenntartásában (Nagy et al., 1999).
A PET alkalmazása gyógyszer-rezisztens gyermekkori epilepsziák műtét előtti kivizsgálásában az elmúlt évtizedben jelentős előrelépést hozott. A következőkben röviden összefoglaljuk az FDG, az FMZ és az AMT PET vizsgálatokra vonatkozó legfontosabb ismereteket és laboratóriumunkban szerzett tapasztalatokat néhány fontos gyermekkori epilepsziában és epilepsziával társuló kórképben.
Temporális lebeny epilepszia
A temporális lebeny epilepszia a leggyakoribb fokális epilepsziák közé tartozik. Bár PET sokszor nem szükséges a diagnózis és a műtéti indikáció felállításához, ellentmondó EEG és MRI leletek esetén a PET segíthet az epileptogén régió lokalizálásában. Hasonlóan a felnőttekhez, gyermekeknél az érintett temporális lebeny gyakran mutat csökkent glukóz felhasználást interiktális PET képeken (4.A ábra). Ezek a csökkent metabolizmusú területek jól megfelelnek a mélyelektródás EEG-vel lokalizált epileptogén áreáknak. Az FDG PET abnormitások azonban általában jóval kiterjedtebbek, mint a hisztopatológiailag kimutatható eltérések. Mediális temporális lebeny epilepsziáknál a laterális temporális kortex is legtöbbször érintett metabolikusan, és gyakori az azonos oldali parietális, frontális területek és a talamusz hipometabolizmusa is (Theodore et al., 1986; Henry et al., 1993a). Bár legtöbbször az érintett területek csökkent glukóz metabolizmusa jellemző, esetenként interiktális hipermetabolizmus is megjelenhet. Ilyenkor a PET vizsgálat alatt készített EEG általában aktív fokális epileptiform kisüléseket mutat, klinikai vagy elektrográfiás roham jelei nélkül (Chugani et al., 1993a). Az EEG monitorozása nélkül ilyen esetekben az epileptogén temporális lebeny lateralizálása FDG PET-tel nem megbízható. Iktális glukóz PET általában véletlenül készül, ha a betegnek epilepsziás rohama zajlik a vizsgálat alatt. Az így megjelenő metabolikus minták nemcsak a roham kiindulási területét lokalizálják, hanem értékes információt nyújthatnak a rohamterjedés irányára vonatkozóan is (Chugani et al., 1994).
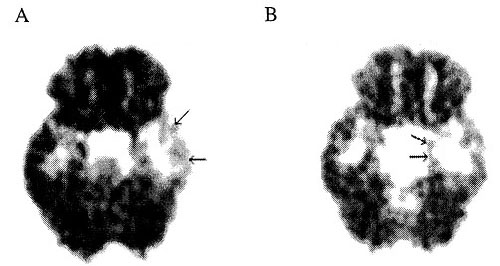
4 ábra • Mediális temporális lebeny epilepszia glukóz PET (A) és flumazenil PET (B) képe. A glukóz PET kiterjedt bal temporális hipometabolizmust mutat (nyilak), amely a temporális cortexen kifejezettebb, mint a mediális temporális struktúrákban. Ezzel szemben flumazenil PET ugyanezen betegnél a mediális temporális területek ((hippocampus és amygdala) csökkent benzodiazepin denzitását igazolta (nyilak), a lateralis kortex érintettsége kevésbé kifejezett.
Az FMZ PET eltérések temporális epilepsziában (TLE) körülírtabbak, mint a glukózfelhasználás abnormitásai és kitűnően korrelálnak az epileptogén zónával (Henry et al., 1992; 1993b). A centrális GABA/benzodiazepin receptor kötődés fokális csökkenése mesialis TLE-nal elsősorban a hippocampust érinti, a laterális temporális kéreg vagy távoli kérgi áreák érintettsége kevésbé jellemző (Koepp et al. 1996) (4.B ábra). Felnőtteknél a hippokampális FMZ kötődés csökkenésének mértéke arányos az MRI volumetriásan mért hippokampális térfogatcsökkenéssel (Koepp et al., 1997). Ez azért fontos, mert a felnőtt hippocampus MRI-vel mért kóros volumencsökkenése rendkívül megbízhatóan jelzi a hippokampális szklerózist, amely a temporális epilepszia legfontosabb patológiai szubsztrátuma. Ilyen vonatkozású megbízható tanulmány gyermekkori TLE-ben nincsen, viszont MRI volumetria sokszor kevésbé informatív, mint felnőtteknél, így csökkent mediális temporális benzodiazepin receptor kötődés segíthet mesialis TLE diagnózisában akkor is, ha a glukóz PET nem mutat lényeges aszimmetriát. Legújabban, MRI koregisztrációval végzett FMZ PET vizsgálatok a talamusz csökkent benzodiazepin receptor kötődését is kimutatták a fókusszal azonos oldalon TLE-ban (Nagy et al., 1998), mely összefügghet az epilepsziás működészavar szubkortikális terjedésével (5. ábra). FMZ PET igen érzékenynek bizonyult kettős patológiát ("dual pathology", DP) mutató epilepsziás betegeknél is az epileptogén léziók kimutatására is (Juhász et al., 1999a). Potenciálisan epileptogén kérgi lézió és hippokampális szklerózis együttes előfordulása nem ritka (terápia rezisztens TLE betegek között 15-30%), és a felderítetlen DP egyik oka lehet a kedvezőtlen műtéti eredményeknek, ha a kérgi lézió eltávolítása mellett az atrófiás hippocampust érintetlenül hagyják (Nakasato et al., 1992; Li et al., 1997; Sisodiya et al., 1997). FMZ PET vizsgálat a műtét előtti kivizsgálás során lehetővé teszi a DP megbízható felderítését, ami különösen hasznos lehet, ha az EEG és a strukturális képalkotó vizsgálatok eredményei ellentmondóak (Juhász et al., 1999a).
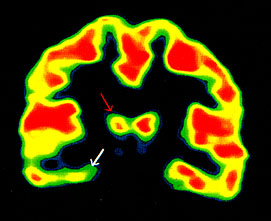
5. ábra • Csökkent benzodiazepin-receptor kötődés a jobb oldali talamuszban (piros nyíl) jobb mediális temporális lebeny epilepsziában szenvedő beteg flumazenil PET képen. A jobb oldali hippocampus (fehér nyíl) jelentős atrófiát és kifejezetten csökkent benzodiazepin receptor denzitást mutatott. A betegnél a mediális temporális kiindulású komplex parciális rohamok szekunder módon generalizálódtak, a terjedés egyik lehetséges útja az érintett talamusz dorzomediális magján keresztül vezet.
Extratemporális epilepsziák
Míg temporális epilepsziákban a műtéti eredmények kiválóak, addig extratemporális fókusz esetén a betegek rohamai az esetek mintegy felében folytatódnak az operációt követően is. Ennek gyakori oka, hogy az elvégzett vizsgálatok nem derítik fel kellő pontossággal az epileptogén területeket. Terápiarezisztens gyermekkori frontális epilepsziákban a nagy felbontású PET á legtöbb esetben csökkent frontális glukóz felhasználást mutat normális MW mellett is (da Silva et al., 1997). Ez különösen akkor fontos, ha a felszíni EEG nem lateralizálja vagy nem lokalizálja megbízhatóan az epileptogén régiót, ami frontális fókusz esetén különösen gyakori. Az epilepsziás fókusz iktális lokalizációja az esetek 80%-ban megfelel a glukóz PET-tel kimutatható eltéréseknek. Extrafrontális metabolikus eltérések azonban a betegek több mint harmadánál megjelennek (da Silva et al., 1997).
Mivel FMZ PET alkalmas neokortikális epileptogén áreák kimutatására (Savic et al., 1995), és a neokortikális benzodiazepin-receptor kötődés csökkenése gyakran körülírtabb, mint a glukóz metabolizmus zavara (Savic et al., 1993), az epileptogén zóna pontosabb lokalizálása érdekében a betegek egy részénél érdemes FMZ PET elvégzését megfontolni. Laboratóriumunkban számos extratemporális epilepsziában szenvedő gyermeknél végeztünk glukóz és FMZ PET vizsgálatot, és a kapott eredményeket az intrakraniális elektródákkal detektált iktális EEG adataival hasonlítottuk össze. A PET eltérések analízisére szemiautomatikus aszimmetria marker programot használtunk, amely lehetővé teszi a kóros kérgi területek kijelölését (részletesen l. Muzik et al. 1998). A módszer segítségével elkerülhető kontroll csoport használata és nem szükséges artériás vérminták gyűjtése sem, mely kisgyermekeknél sokszor nehezen kivitelezhető. A PET eltéréseket a nagyfelbontású MRI képekből rekonstruált kéregfelszín képére vetítettük. Ugyanitt megjeleníthetőek az intrakraniális grid elektródák is (6.A ábra). E vizsgálatok azt mutatják, hogy az FMZ PET eltérések (6.C ábra) minden esetben magukban foglalják azt a kéregterületet, ahonnan az epilepsziás roham kiindul ("seizure onset"), míg az FDG PET esetenként kevésbé szenzitív ilyen szempontból (da Silva et al., 1998). Így a FMZ PET szignifikánsan érzékenyebb a rohamkiindulás zónájának lokalizálásában. Az FMZ PET eltérések a legtöbb esetben kisebbek, mint az FDG PET abnormitásai (6.B-C ábra), ezért a rezekció határainak kijelölésében jobb segítséget nyújthatnak, mint az FDG PET eltérések. FMZ PET abnormitások az epileptogén zónán kívül is megjelenhetnek (6.C ábra), de ezek reverzibilisek lehetnek, amit a műtét utáni benzodiazepin kötődés normalizálódása bizonyít (Savic et al., 1998). Előzetes adataink azt mutatják, hogy az FMZ PET felhasználása gyermekkori extratemporális epilepsziák műtét előtti kivizsgálásában nemcsak segíthet az invazív elektródák helyének meghatározásában, de esetenként elkerülhetővé teheti az invazív monitorozást. PET alkalmazása a preoperatív kivizsgálás során jelentősen javít e betegcsoportban a műtéti eredményeken: a műtött betegek kb. 70%-a rohammentessé válik.
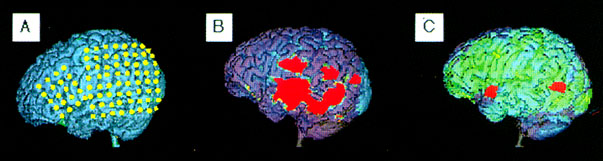
6. ábra • Terápiarezisztens epilepszia miatt vizsgált egyéves gyermek koponya MRI-je negatív volt. Iktális scalp EEG bal hátsó temporális-parietális fókuszt mutatott. Szubdurális grid elektródákkal (A) történt monitorozás ezt megerősítette (a képen a két grid agyfelszínhez képest való elhelyezkedése látszik). Glukóz PET (B) kiterjedt, multiplex hipometabolizmust mutatott fronto-parietotemporálisan (vörössel jelzett területek). Flumazenil PET ugyanakkor csak két, körülírt abnormitást detektált (C); a hátsó terület az invazív EEG-vel lokalizált epilepsziás fókusznak megfelelt.
FMZ PET esetenként segíthet az epileptogén zóna lokalizálásában akkor is, ha MRI kérgi strukturális léziát igazol, mivel az epileptogén területek gyakran a lézió határain túlterjednek. Ilyenkor az agyfelszínre vetített FMZ PET eltérések kimutatják a csökkent benzodiazepin-receptor denzitású területeket a strukturálisan látszólag ép kéregterületekben is (Juhász et al., 1999b) (7. ábra).
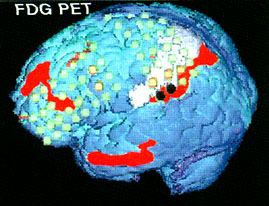
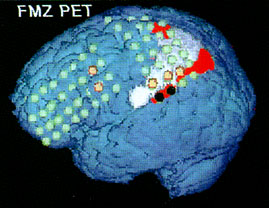
7. ábra • Tizenhat éves lány bal féltekei lézió (angiomatózis; fehér terület az agyfelszínen) és gyógyszerrezisztens epilepszia miatt került vizsgálatra. FDG PET három nagykiterjedésű hipometabolikus áreát mutatott (pirossal jelölt területek) a parietális, frontális és temporális lebenyben. FMZ PET ugyanakkor csak a léziónak megfelelően és a lézió mögötti keskeny sávban mutatott csökkent benzodiazepin receptor kötődést: ez a peri-lézionális kérgi terület volt az epilepsziás rohamok kiindulási helye (feketével jelzett elektródák; a narancssárga elektródák a korai rohamterjedés helyeit jelölik).
Az infantilis spazmus a legsúlyosabb kimenetel gyermekkori epilepsziák közé tartozik, a gyógyszeres kezelés gyakran eredménytelen. A PET alkalmazása e betegségben elsősorban az ún. "kriptogén" csoportban hozott előrelépést. E betegeknél egyéb képalkotó vizsgálatok nem jeleznek fokális eltérést, míg a glukóz PET vizsgálat gyakran mutat körülírt kérgi hipo- vagy esetenként hipermetabolizmust (8. ábra), mely sokszor jól korrelál az EEG által kimutatott fókusszal (Chugani et al., 1993 b). A PET segítségével így a korábban "kriptogénnek" tartott betegek jó része a "szimptómás" csoportba osztályozható (Chugani és Conti, 1996), ahol a műtéti eredmények biztatóak. Egyetlen körülírt PET abnormitás esetén a kóros glukóz metabolizmust mutató terület rezekciója jó rohamkontrollt eredményez, különösen ha a PET és az EEG eltérések azonos régióra lokalizálódnak. A rezekált agyszövet leggyakrabban kortikális diszpláziát mutat (Chugani et al. 1990). Sikeres műtét nemcsak a rohamok megszűnéséhez vezet, de a többnyire társuló fejlődési elmaradás is jelentősen javulhat. Sajnos a betegek négyötödénél multiplex hipometabolikus áreákat látunk, melyek gyakran nem korrelálnak az EEG eltérésekkel. A fokális vagy multifokális kérgi eltérések gyakori jelenléte és a kérgi rezekció jó eredményei infantilis spazmusban arra utalnak, hogy a betegség alapvetően fokális eredet, és a többnyire szimmetrikus klinikai tünetek korfüggő szekunder generalizáció eredményei. Erre utalnak az agytörzs és a nucl. Lentiformis metabolikus eltérései is (Chugani et al. 1992). Multifokális abnormitások esetén műtét nem jön szóba, vagy eredménye kétséges. Mégis, gyógyszerrezisztens infantilis spazmusban FDG PET elvégzése javasolt és fokális abnormitások esetén a műtét megfontolandó, mivel a betegség enélkül általában súlyos kimenetelű.
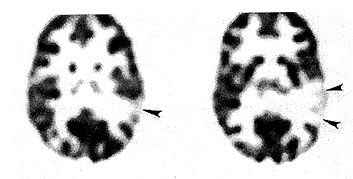
8. ábra • Kifejezett, körülírt temporális hipometabolizmus (nyilak9 "kriptogén" infantilis spazmusban szenvedő gyermeknél. Koponya MRI negatív volt.
Lennox-Gastaut szindróma
Infantilis spazmushoz hasonlóan, Lennox-Gastaut szindrómás betegeken végzett PET vizsgálatok is fokális kérgi eltéréseket mutathatnak ki, amelyek PET nélkül nem detektálhatók. Ez lehetőséget ad a műtéti kezelésre, ha a PET fókusz korrelál az iktális EEG eltérésekkel. A műtét kimenetele a kognitív funkciók javulása szempontjából azonban kevésbé kedvező, mint infantilis spazmus esetén. A glukóz metabolizmus mintái alapján négy metabolikus altípus különböztethető meg: féloldali fokális, féloldali diffúz, kétoldali diffúz hipometabolizmus, valamint normális metabolizmus (Chugani et al., 1987). Féloldali diffúz hipometabolizmus esetén általában lateralizált epileptiform kisülések is megjelennek a generalizált 1-2,5 Hz tüskehullám tevékenység mellett. Ilyenkor, ha iktális EEG bizonyítja, hogy a rohamok mindig a csökkent metabolizmusú féltekéből indulnak, kallozotómia vagy hemiszferektómia jó rohamkontrollt eredményezhet (Chugani és Dietrich 1992). A betegek többségénél viszont kétoldali diffúz hipometabolizmus van jelen, így kérgi rezekció nem eredményes, viszont kallozotómia esetenként itt is szóba jöhet, a klinikai és elektrográfiás képtől függően.
Szklerózis tuberóza
A szklerózis tuberóza a herediter fakomatózisok (a histiogenezis zavarai) közé tartozik, ahol autoszomális domináns öröklődés mellett változatos klinikai tünetek jelenhetnek meg. Szklerózis tuberózában szenvedő betegek többnyire mentálisan retardáltak és több mint 90%-uknál jelentkeznek epilepsziás rohamok. Ezek klinikailag megnyilvánulhatnak infantilis spazmus képében, de mioklónusos és parciális rohamok is gyakran előfordulnak. Az agyban általában nagyszámú meszes kérgi és kamraközeli csomó (9.A ábra) látható, melyek interiktálisan csökkent glukóz metabolizmust mutatnak (9.B ábra), míg iktális PET-en az epileptogén tuber hipermetabolikus zónaként mutatkozik. FDG PET a betegek mintegy 90%-ánál mutat ki fokális vagy multifokális kérgi eltéréseket, esetenként olyan területeken is, ahol az MRI nyilvánvaló tubert nem mutat (Rintahaka és Chugani, 1997). Epileptogén tuber rezekciója rohamkontrollhoz vezethet, de glukóz PET nem alkalmas az epileptogén és nem epileptogén léziók megkülönböztetésére. Ilyen célból az FMZ PET sem bizonyult megbízhatónak. Újabban viszont AMT PET-tel végzett vizsgálatok az epilepsziás fókusznak megfelelő tuber fokozott szerotonin szintézisét mutatták (9.C ábra), így az AMT PET minden eddiginél hatékonyabb módszer lehet az epileptogén tuberek noninvazív szelektálására (Chugani et al., 1998).
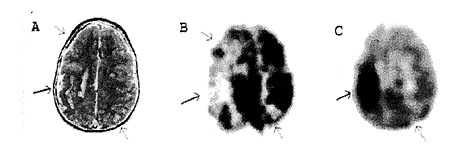
9. ábra • Nyolcéves epilepsziás leány koponya MRI-je (A) multiplex kalcifikált elváltozásokat mutatott, ezek közül egy (vastg nyíllal jelölve) különösen nagykiterjedésű volt (szklerózis tuberoza képe). Glukóz PET (B) a meszes lézióknak megfelelően számos hipometabolitikus területet ábrázolt. Iktális EEG szerint az epilepsziás rohamok a nagyméretű lézió régiójából indultak ki, amely alfaj (11C)metil-L-triptofán (AMT) PET-en (C) fokozott aktivitást mutatott, míg a többi lézió csökkent aktivitású volt. Az AMT PET így hatékony noninvazív módszer lehet az epileptogén tuberek kiválasztására műtét előtti kivizsgálás során.
Sturge-Weber szindróma
A Sturge-Weber szindróma sporadikusan megjelenő neurokután betegség, neurológiai tünetei közül gyakoriak az agyi kalcifikációk, epilepszia, hemiparézis, hemianopszia (Sujansky és Conradi, 1995). FDG PET általában a faciális névusszal azonos oldali féltekében mutat hipometabolizmust, és alkalmas a féltekei érintettség mértékének és kiterjedésének megállapítására (Chugani et al., 1989). Paradox módon, kisgyermekeknél interiktális hipermetabolizmus lehet jelen. Ennek pontos okát nem tudjuk, de összefügghet a krónikusan iszkémiás félteke anaereob glukóz metabolizmusával (Chugani et al., 1989).
Hemimegalencefália és Rasmussen encefalitisz
Hemimegalencefáliában az egyik oldali agyfélteke kongenitálisan hipertrófiás, ami azonos oldali ventrikulomegáliával társul. A nagyobb félteke általában erősen epileptogén, emiatt gyakran van szükség hemiszferektómiára az epilepsziás rohamok kiküszöbölése céljából (Vigevano et al., 1989). A nagyon gyakori rohamok miatt az ilyen betegek FDG PET-je többnyire iktális, a strukturálisan kóros félteke jellemzően súlyos elváltozásokat mutat (10. ábra). A glukóz PET haszna elsősorban a másik oldali agyfélteke funkcionális integritásának kimutatásában rejlik. Itt ugyanis gyakoriak a fokális PET eltérések, és ezek foka segít a várható műtéti prognózis megítélésében (Rintahaka et al., 1993). Mindazonáltal a hemimegalencefáliás betegek kognitív funkciói általában nem állnak helyre hemiszferektómiát követően olyan mértékben, mint ahogy Sturge-Weber szindrómában, kongenitális hemiplegiában vagy krónikus fokális (Rasmussen) encefalitiszben gyakran tapasztaljuk. Ez utóbbi kórképnél a korai metabolikus elváltozások főleg az elülső agyterületeket érintik, később viszont inkább diffúz féltekei hipometabolizmus jellemző. A kórlefolyással progrediáló metabolikus eltérések magyarázhatják, hogy korai hemiszferektómiát követően a kognitív funkciók jobban helyreállnak, mint a betegség késői szakaszában. A nem rezekált prefrontális kéreg glukóz metabolizmusának emelkedése műtét után szintén összefügg a kognitív javulással (Caplan et al., 1995).
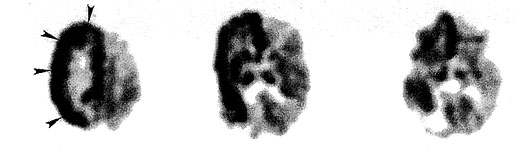
10. ábra • Hemimegalencefália jellegzetes glukóz PET képe. A jobb félteke (nyilakkal jelőlve) kórosan megnagyobbodott, és a vizsgálat közben is zajló epilepsziás aktivitás miatt kiterjedt hipermetabolizmust mutat. Az ellenoldali agyfélteke ugyanakkor az életkornak megfelelő metabolikus mintát mutat.
Heterotópiák
Heterotópiás neuroncsoportok a fetális életben zajló neuroblaszt migráció zavara esetén jönnek létre. Ezek általában a szubkortikális fehérállományra lokalizálódnak és MRI-vel többnyire kimutathatók. Az aberráns heterotópia szinaptikus kapcsolatai révén lehet fokális epilepszia kiindulási helye. FDG PET képeken a heterotópiás terület általában relatíve fokozott metabolizmusú régióként mutatkozik a körülötte lévő fehérállományhoz képest. A felette lévő kortex többnyire hipometabolikus, feltehetően mivel kevesebb neuront és szinapszist tartalmaz (11. ábra). Különösen fiatal gyermekeknél MRI-vel nehezen lehet a normális és heterotópiás régiókat elkülöníteni; FDG PET itt nagy segítséget nyújthat a diszgenezis kiterjedésének megállapításában. Nagyméretű heterotópiák involválhatják a hippocampus melletti fehérállomány régiókat is, ami megnehezítheti esetleges hippokampális szklerózis detektálását és "kettős patológia" kimutatását is (1. temporális epilepsziáknál).
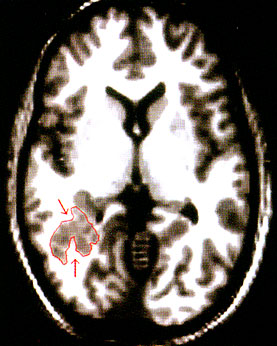
11. ábra • Nagykiterjedésű jobb oldali heterotópia a hátsó temporális fehérállományban (A; nyilak és pirossal körülhatárolt terület) axiális MR felvételen. Ugyanitt glukóz PET (B) relatíve fokozott metabolizmust mutatott (vastag nyilak), míg a felette lévő kortex súlyosan csökkent glukóz metabolizmusú.
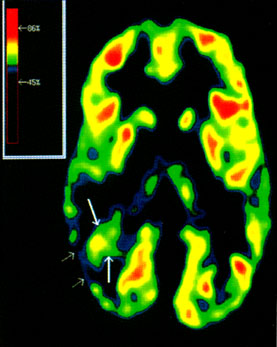
Ilyen esetekben a PET és az MRI koregisztrációja és a hippokampális benzodiazepin kötődés kvantitatív analízise segíthet a kóros hippocampus felderítésében (Juhász et al., 1999a). [15O]H2O PET-tel készült vizsgálatok (12. ábra) azt is kimutatták, hogy ezek a heterotópiás neuroncsoportok gyakran funkcionálisan aktívak, pl. részt vesznek kognitív működésekben, és más kéregterületek neuronjaival állnak funkcionális kapcsolatban (Müller et al., 1998). Ennek ismerete egy esetleges epilepsziaműtét előtt fontos.
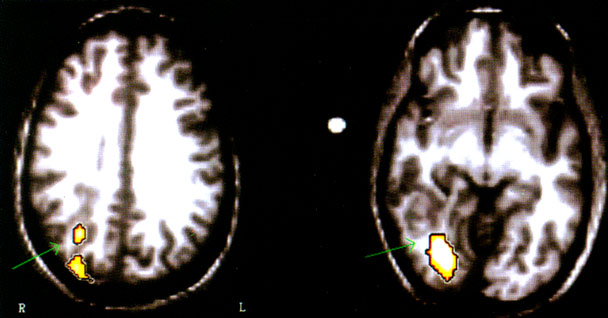
12. ábra • Az előző ábrán mutatott betegnél [150]H20 PET a jobb hátsó területek jelentős vérátáramlás fokozódását mutatja vizuális tárgymegnevezés (a képen), valamint faciális és vizuospaciális diszkrimináció során, az aktiváció a heterotópia területét is érintette (nyíl).
PET alkalmazása egyéb gyermekkori neuropszichiátriai kórképekben
A PET számos egyéb gyermekkori neuropszichiátriai kórképben nyújt hasznos és más módszerrel nehezen pótolható diagnosztikus és prognosztikai információt, illetve segíthet a terápiás beavatkozások funkcionális következményeinek vizsgálatában. Ezek közül különösen olyan betegségeknél került vagy kerülhet előtérbe a PET alkalmazása, ahol a strukturális neuroimaging vizsgálatok nem mutatnak specifikus eltéréseket és sokszor egyéb objektív biológiai marker sem áll rendelkezésre a diagnózis felállítására.
Infantilis spazmus PET vizsgálatai során figyeltek fel először arra, hogy a betegek egy része (kb. 10%-a) jól jellemezhető csoportot alkot, akiknél mindkét oldali temporális lebenyben (elsősorban a felső temporális gyrusban és a hippocampusban) közel szimmetrikus hipometabolizmus látszik (13. ábra). E betegek a súlyos epilepszia mellett autisztikus vonásokat mutatnak. Az autizmust leggyakrabban súlyos verbális és nonverbális kommunikációs zavar, a szociális interakciók zavara, sztereotip mozgások jellemzik. Kb. 2000 gyermek közül egy autista, és a betegség fiúk között négyszer gyakoribb. A betegség neurobiológiai alapjai csak részben tisztázottak, de a temporális lebeny, illetve a hippocampus eltéréseinek patofiziológiai szerepe valószínű (Delorng 1992), amit a glukóz PET vizsgálatok is alátámasztanak. Újabban a szerotonin szintézis AMT PET vizsgálata (l. feljebb) autista fiúknál a frontális kortex és az azonos oldali talamusz csökkent szerotonin szintézisét mutatta, melyhez az ellenoldali kisagy nucleus dentatusának fokozott szerotonin szintézise társult (14. ábra) (Chugani et al., 1997). E három struktúra a dentáto-taiamo-kortikális pálya állomásait képviseli, melyen keresztül a kisagy az ellenoldali frontális kéreggel (prefrontális kéreg, Broca mező, motoros mező és szupplementer motoros área) áll összeköttetésben. E területek fontos szerepet játszanak a beszédfunkciókban és a szenzoros integrációban, és aberráns szerotoninerg innervációjuk összefügghet az autizmusban észlelt súlyos viselkedésbeli zavarokkal. E struktúrák beszéd során történő kóros aktivációja az agyi vérátfolyás PET vizsgálatával kimutatható és további bizonyítéka annak, hogy e területek abnormális működése szerepet játszhat a tünetek kialakulásában (Müller et al., 1998). Újabban PET-tel azt is sikerült kimutatni, hogy autista gyermekeknél elmarad a szerotonin-szintézis korábban vázolt kora gyermekkori platófázisa (Chugani et al.. 1997), amely valószínűleg befolyásolja az érintett agyterületek szinaptógenezisét (3.B ábra). E vizsgálatok új és izgalmas lehetőségeket nyújthatnak e betegség diagnózisában és a racionális terápiás megközelítések kidolgozásában.

13. ábra • Kétoldali súlyos temporális (és enyhébb parietális) hipometabolizmus (nyíllal jelölve) infantilis spazmusban szenvedő és kifejezett autisztikus vonásokat mutató gyermeknél. Koponya MRI normális volt.
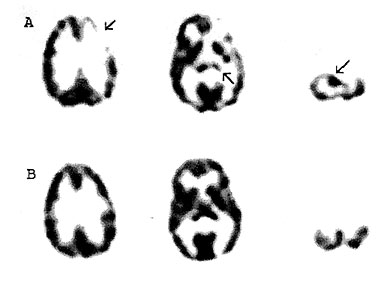
14. ábra • Az AMT PET csökkent szerotonin-szintézis rátát mutat 7 éves autista fiú frontális kortexében, az azonos oldali talamuszban és az ellenoldali kisagy nucleus dentatusában. B.: Ugyanezen fiú egészséges, 9 éves fiútestvérénél az AMT PET normális szerotonin-szintézist mutat.
Hasonlóan az autizmushoz, az utóbbi években egyre több, gyermekkori viselkedészavarral járó kórképnél (pl. "attention deficit hiperactivity disorder" [ADHD], epilepsziával társuló agresszivitás stb.) sikerült PET-tel objektív és jól jellemezhető, körülírt funkcionális eltéréseket találni. Mindezen vizsgálatok még csak kezdeti lépéseket jelentenek e betegségek neurobiológiai hátterének jobb megismerésében. Nem kétséges azonban hogy a közeljövőben a gyarapodó tapasztalatok révén a PET alkalmazása e gyermekkori betegségekben is új, hatékony, objektív diagnosztikus megközelítéseket tesz lehetővé, ami egyben feltétele a hatásos kezelési stratégiák alkalmazásának is.
Egy másik, újabb terület a HIV vírussal fertőzött gyermekek glukóz PET vizsgálata. AIDS betegségben neurológiai tünetek esetén a központi idegrendszer glukóz metabolizmusának zavarai általában a klinikai kép alapján elvárt mértéknél kiterjedtebbek. Ugyanakkor a glukóz PET képes kóros agyi metabolizmus kimutatására vertikálisan fertőzött gyermekeknél már tünetmentes stádiumban is (Depas et al., 1995), és hasznos diagnosztikai módszer manifeszt AIDS betegség központi idegrendszeri szövődményeinek elkülönítő vizsgálatában is (15. ábra) fokozott glukózfelvétel általában malignus folyamatra utal, míg egyéb szövődmények inkább körülírt vagy diffúz hipometabolizmussal járnak (Heald et al., 1996).
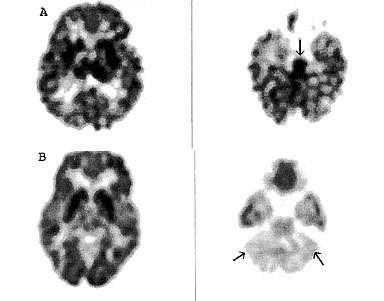
15. ábra • A.: Kétéves, vertikálisan fertőzött AIDS-es fiúnál jobbratekintési bénulás alakult ki. Az MRI agytörzsi léziót mutatott. Glukóz PET diffúzan csökkent kérgi glukóz felvétel mellett az agytörzs (l. nyíl) jobb hátsó részében mutatott kifejezett hiperaktivitást, ami malignus folyamatot valószínűsített. A biopszia limfómát igazolt. B: Hétéves, vertikálisan fertőzött AIDS-es kislány fokozódó kognitív zavar és baloldali végtaggyengeség miatt került vizsgálatra. Az MRI a kisagyban jelzett fokozott szignált. A glukóz PET súlyos diffúz agyi hipometabolizmus (a bazális ganglionok a csökkent kérgi aktivitás miatt prominensek) mellett kifejezett kisagyi hipometabolizmust (nyíllal jelölve) mutatott, ami malignus folyamat ellen szólt. A szövettani vizsgálat progresszív multifokális leukoencefalopátiát (PML) igazolt.
Mivel napjainkban egyre több lehetőség van a betegség kialakulásának késleltetésében, és a szövődmények megelőzésében és kezelésében, e vizsgálatok segíthetnek a korai diagnózisban és a kezelés funkcionális hatásainak monitorozásában is. E rövid összefoglalóban igyekeztünk rámutatni arra, hogy a gyermekagy nagymértékű funkcionális plaszticitással rendelkezik, amely agresszív terápiás beavatkozásokra bátorít korábban még annyira reménytelennek látszó betegségek esetében is, mint pl. számos gyógyszerrezisztens epilepszia. A sikerrel kecsegtető beavatkozásokra alkalmas betegek kiválasztásában, a műtét tervezésében és a beavatkozás funkcionális következményeinek követésében a PET már jelenleg is pótolhatatlan szerepet játszik. Újabb, még specifikusabb PET tracerek alkalmazása a jövőben a PET jelentőségét e területen tovább növelheti.
IRODALOM
1 Chugani HT, Phelps ME. Maturational changes in cerebral function in infants determined by (18)FDG positron emission tomography. Science 1986: 231:840.
2 Chugani HT, Phelps ME, Mazziotta JC. Positron emission tomography study of human brain functional development. Ann Neurol 1987;22:487
3 Chugani HT, Hovda DA, Villablanca JR, et al. Metabolic maturation of the brain: A study of local cerebral glucose utilization in the developing cat. J Cereb Blood Flow Metab 1991;11:35.
4 Huttenlocher PR, Dabholkar AS. Regional differences in synaptogenesis in human cerebral cortex. J Comp Neurol 1997; 387:167-178.
5 Muzik O, Chugani DC, Chakraborty P, Mangner T, Chugani HT. Analysis of [C-11]alpha-methyl-tryptophan kinetics for the estimation of serotonin synthesisrate in vivo. J Cereb Blood Flow Metab 1997;17:659-69
6 Chugani DC. Muzik O, Chakraborty PK, et al. Human brain serotonin synthesis capacity measured in vivo with alpha[11C]methyl-L-tryptophan. Synapse 1998; 28:33-43.
7 Lauder JM, Krebs H. Serotonin as a differentiation signal in early embryogenesis. Dev Neurosci 1978:1:15-30.
8 Whitaker-Azmitia PM, Lauder JM, Shemmer A, Azmitía EC. Postnatal changes in serotoninl receptors following prenatal alterations in serotonin levels: further evidence for functional fetal serotoninl receptors. Dev Brain Res 1987;33:285-289.
9 D'Amato RJ. Blue ME. Largent BL, et al. Ontogeny of the serotonergic projection to rat neocortex: transient expression of a dense innervation to primary sensory areas. Proc Natl Acad Sci USA 1987; 84:4322-4326
10 Bennett-Clarke CA, Leslie MJ, Lane RD. Rhoades RW. Effect of serotonin depletion on vibrissae-related patterns in the rat's somatosensory cortex. JNeurosci 1994:14:7594-7607.
11 Nagy F, Chugani DC, Juhasz C, et al. Altered in vitro and in vivo flumazenil binding in human epileptogenic neocortex. J Cereb Blood Flow Metab 1999 (in press).
12 Theodore WH, Holmes MD, Dorwart RH et al. Complex partial seizures: cerebral structure and cerebral function. Epilepsia 1986; 27:576-582.
13 Henry TR, Chugani HT, Abou-Khalil BW, Theodore WH, Swartz BE. Positron emission tomography. In: Engel Jr J (ed.). Surgical treatment ofepilepsies. New York: Raven Press. 1993a: 211-243.
14 Chugani HT, Shewmon D, Khanna S, Phelps M. Interictai and postictal focal hypermetabolism on positron emission tomography. Pediatr Neurol 1993a; 9 :10-15.
15 Chugami HT, Rintahaka P. Shewmon D. Ictal patterns of cerebral glucose utilization in children with epilepsy. Epilepsia 1994; 35:813-822.
16 Henry TR, Frey KA, Sackellares JC, et al. Anterior mesial temporal benzodiazepine receptor decrease on [11C]flumazenil PET agrees with multimodal localization of epileptogenesis in refractory complex partial seizures. Neurology 1992; 42(Suppl 3):297-298.
17 Henry TR, Frey KA, Sackellares JC, et al. In vivo cerebral metabolism and central benzodiazepinereceptor binding in temporal lobe epilepsy. Neurology 1993b; 43 :1998-2006.
18 Koepp MJ, Richardson MP, Brooks AJ. et al. Cerebral benzodiazepine receptors in hippocampal sclerosis. An objective in vivo analysis. Brain 1996; 119:1677-87.
19 Koepp MJ, Richardson MP, Labbé C, et al. 11C-flumazenil PET volumetric MRI and quantitative pathology in mesial temporal lobe epilepsy. Neurology 1997; 49: 764-73.
20 Nagy F, Juhasz C, da Silva EA, Shah J, Muzik O, Watson C, Chugani HT. Decreased [11C]-flumazenil binding in dorsomedial thalamic nucleus in human focal epilepsy: a PET study. Epilepsia 1998; 39(Suppl 6):102.
21 Juhasz C, Nagy F, Watson C, Muzik O, Shah J, Chugani HT [11C]-flumazenil PET in patients with epilepsy with dual pathology. Epilepsia 1999a (in press)
22 Nakasato N, Levesque MF. Babb TL. Seizure outcome following standard temporal lobectomy: correlation with hippocampal neuron loss and extrahippocampal pathology. JNeurosurg 1992: 77:194-200.
23 Li LM, Cendes F, Watson C, et al. Surgical treatment of patients with single and dual pathology. Neurology 1997;48:437-44.
24 Sisodiya SM, Moran N, Free SR, et al. Correlation of widespread preoperative magnetic resonance imaging changes with unsuccesful surgery for hippocampal sclerosis. Ann Neurol 1997; 41: 490-6.
25 da Silva EA, Chugani DC, Muzik O, Chugani HT. Identification of frontal lobe epileptic foci in children using positron emission tomography. Epilepsia 1997;38:1198-208.
26 Savic I, Thorell JO, Roland P. [11C] Flumazenil positron emission tomography visualizes frontal epileptogenic regions. Epilepsia 1995; 36:1225-32.
27 Savic I, Ingvar M. Stone-Elander S. Comparison of [11C]flumazenil and [18]FDG as PET markers of epileptic foci. J Neurol Neurosurg Psychiatry 1993;56:615-621.
28 Muzik O, Chugani DC, Chenggang Shen et al. Objective method for localization of cortical asymmetries using positron emission tomography to aid surgical resection of epileptic foci. Computer Aided Surgery 1998;3:74-82.
29 da Silva EA, Nagy F, Juhasz C, et al. Flumazenil and glucose PET scanning in extratemporal lobe epilepsy: correlation with intracranial EEG. Epilepsia 1998;39(Suppl 6):83.
30 Savic I, Blomqvist G, Halldin C, Litton JE, Gulyas B. Regional inereases in [11C]flumazenil binding after epilepsy surgery. Acta Neurol Scand 1998; 97:279-286.
31 Juhasz C, da Silva EA, Watson CE, et al. Comparison of [11C]flumazenil and glucose PET bnormalities in patients with epilepsy and brain lessions. Neurology 1999b:52(suppl 2):A58.
32 Chugani HT, Shewmon D. Shíelds W, et al. Surgery for intractable infantile spasms euroimaging perspectives. Epilepsia 1993b;34:764-71
33 Chugani HT, Conti J. Etiological classification of infantile spasms in 140 cases: role of ositron emission tomography. J Child Neurol 1996;11:44-8.
34 Chugani HT, Shields W. Shewmon D, Olson D, Phel s M Peacock W. Infantile spasm: I. PET identifies focal cortical dysgenesis in cryptogenic cases for surgical treatment. Ann Neurol 1990; 27:406-413.
35 Chugani HT, Shewmon D, Sankar R, Chen B, Phelps M. Infantile spasms: II. Lenticular nuclei and brainstem activation on positron emission tomography. Ann Neurol 1992; 31:212-219.
36 Chugani HT, Mazziotta JC, Engel J Jr, Phelps ME. The Lennox-Gastaut syndrome: metabolic subtypes determined by 2-deoxy-2[18]fluoro-D-glucose positron emission tomography. Ann Neurol 1987; 21:4-13
37 Chugani HT, Dietrich RB. Pediatric Dísorders. In: Mazziotta JC and Gilman S (eds.), Clinical brain imaging: principles and applications. F.A. Davis Co. (Philadelphia) 1992; 411-457.
38 Rintahaka PJ, Chugani HT. Clinical role of positron emission tomography in children with tuberous sclerosis complex. J ChildNeurol 1997;12:42-52.
39 Chuganí DC. Chugani HT, Muzik O, Shah JR, Shah AK, Canad A Man er TJ. Chakraborty PK. Imaging epileptogenic tubers in children with tuberous sclerosis complex using alpha-[11C]methyl-L-tryptophan positron emission tomography. Ann Neurol 1998; 44:858-66.
40 Sujansky E, Conradi S. Sturge-Weber syndrome: age of onset of seizures and glaucoma and the prognosis for alfected children. J ChildNeurol 1995;10:49-58.
41 Chuganí HT, Mazzíotta JC, Phelps ME. Sturge-Weber syndrome: a study of cerebral glucose utilizalion with positron emission tomography. JPediatr 1989;114: 244-253.
42 Vigevano F, Bertini E, Boldrini R, et al. Hemimegalencephaly and intractable epilepsy: benefits of hemispherectomy. Epilepsia 1989; 30: 833-834.
43 Rintahaka PJ, Chugani HT, Messa C, Phelps M. Hemimegalencephaly: evaluation with positron emission tomography. Pediatr Neurol 1993; 9:21-28.
44 Caplan R, Curtiss S, Chugani HT, Vinters HV. Pediatric Rasmussen encephalitis: social communication, language, PET and pathology before and after hemispherectomy. Brain Cogn 1996;32:45-66.
45 Muller RA. Behen ME, Muzik O, et al. Task-related activations in heterotopic brain malformations: a PET study. Neuroreport 1998;9:2527-2533.
46 DeLong GR. Autism, amnesia, hippocampus, and learning. Neurosci Biobehav Rev 1992;16:63-70.
47 Chugani DC, Muzik O, Rothermel R, et al. Altered serotonin synthesis in the dentatothalamocortical pathway in autistic boys. Ann Neurol 1997;42:666-669.
48 Muller RA, Chuganí DC, Behen ME, et al. Impairment of dentato-thalamo-cortical pathway in autistic men: language activation data from positron emission tomography. Neurosci Lett 1998;245:1-4.
49 Depas G, Chiron C, Tardieu M, et al. Functional brain imaging in HIV-1-infected children born to seropositive mothers. JNucl Med 1995;36:2169-2174
50 Heald AE, Hoffman JM, Bartlett JA, Waskin HA. Differentiation of central nervous system lesions in AIDS patients using positron emission tomography (PET). Int JSTD AIDS 1996;7:337-346